病毒的跨物种传播是全球公共卫生面临的重大威胁之一,例如多次的流感病毒与冠状病毒的全球性大流行,人群外宿主传播为病毒的生存、重组和变异提供了天然的途径。深入解析人兽共患病毒的跨物种传播机制,对于制定前瞻性、有效的预防与控制策略具有至关重要的意义。
戊型肝炎病毒(Hepatitis E virus,HEV)在我国近10年主要经由家猪相关肉制品的污染引发散发性流行,是典型的人畜共患病。HEV也是全球急性病毒性肝炎的最主要病因之一,每年造成约2000万感染,其中出现临床症状的病例约330万。在我国,戊肝报告发病数常年超过甲肝,居急性病毒性肝炎首位。值得注意的是,不同基因型HEV的宿主范围与流行特征存在显著差异:基因1型(HEV-1)和2型(HEV-2)的宿主范围相对狭窄,仅感染人和非人灵长类动物,主要在卫生条件较差的国家和地区经水源污染引起暴发性流行;而基因3型(HEV-3)和4型(HEV-4)呈现全球散发流行态势,并表现出广泛的宿主嗜性。除人类外,还可以感染猪、鹿等多种动物,其中猪被认为是HEV的主要动物中间宿主。相关数据显示,在我国养殖家猪中抗HEV抗体的阳性率高达92.8%,家猪的粪便样本中HEV核酸的阳性率亦达44%。然而,目前不同基因型HEV宿主嗜性差异的分子机制仍然未知。
我院夏宁邵教授、郑子峥教授团队利用一株特异性识别HEV-3和HEV-4的单克隆抗体6H8作为“分子探针”,成功鉴定出HEV衣壳蛋白上一个仅存在于HEV-3和HEV-4的特异性抗原表位。通过晶体结构和冷冻电镜(Cryo-EM)分析,该抗原表位被精确定位于衣壳蛋白二聚体的头部区域,由480-loop和530-loop两个表面环区共同构成。序列比对及结构分析进一步揭示,在这两个表位关键环区中,483、490及492三个位点在HEV-1/2和HEV-3/4间存在保守性差异,其中490和492位氨基酸直接参与抗体6H8的相互作用。具体而言,在HEV-1/2中,490和492位分别为甘氨酸(G)和缬氨酸(V),而在HEV-3/4中则对应为天冬酰胺(N)和甲硫氨酸(M)。突变验证和动力学分析结果显示,490位天冬酰胺(490N)是抗体6H8与HEV衣壳蛋白特异性结合的关键决定因素,而492位甲硫氨酸(492M)对维持该抗原表位的稳定构象发挥重要作用。细胞模型实验结果显示将HEV-4的490N/492M突变为HEV-1的490G/492V后,其对猪肝细胞的感染能力完全丧失;反之,将HEV-1的490G/492V突变为490N/492M后,HEV-1获得了吸附和感染猪肝细胞的能力。进一步的动物体内实验结果证实,HEV-4的490G/492V突变体完全破坏其对猪的感染能力;但HEV-1的490N/492M突变体则无法重建其对猪的体内感染能力。这一结果表明,尽管490N/492M是HEV感染猪的关键因素,但HEV-3/4对猪的感染能力还受到其他未知或协同因素的共同调控。
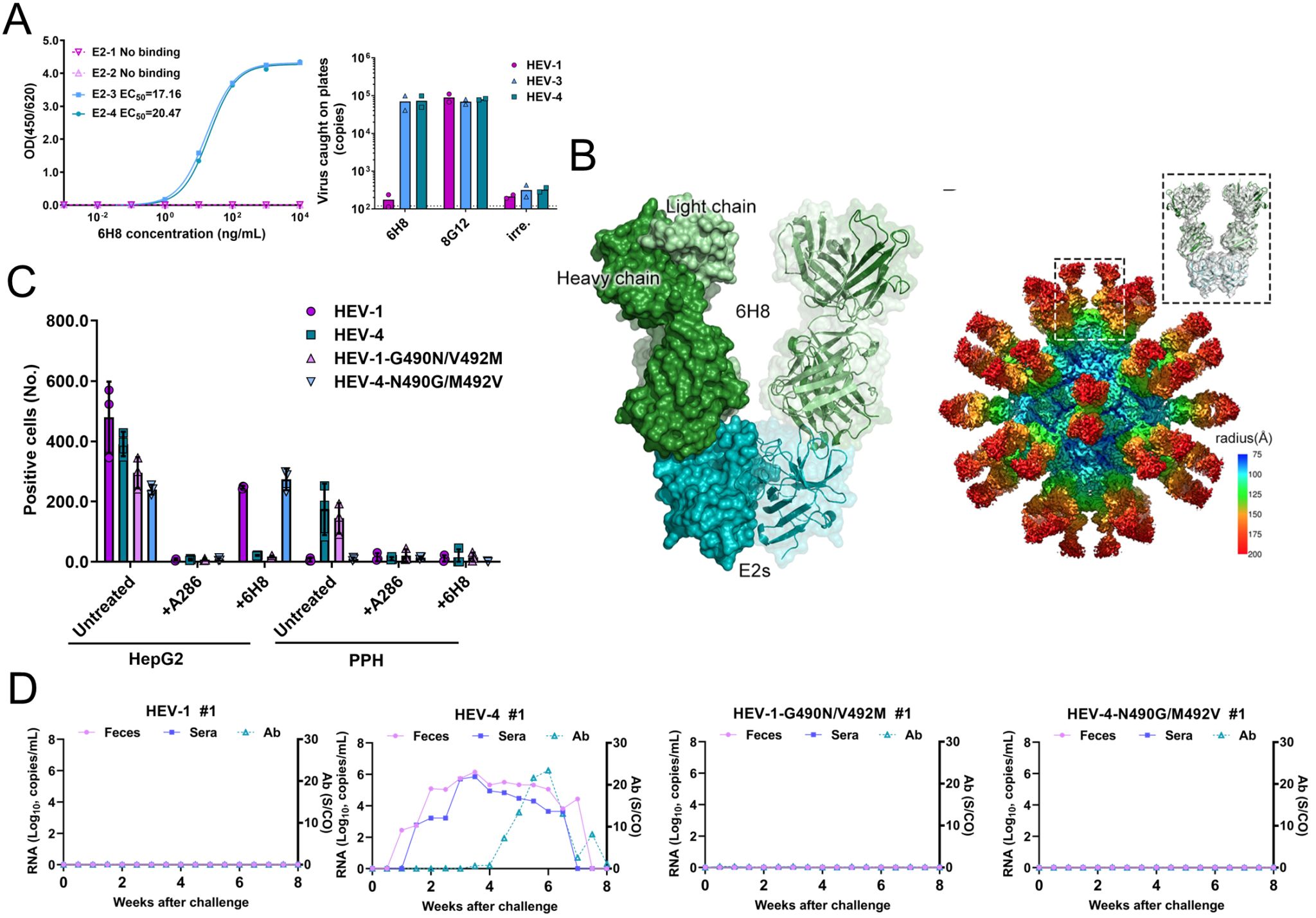
图. 490和492位点是6H8表位的关键氨基酸,可以重建HEV-1对猪肝细胞的感染能力
总而言之,该研究揭示了HEV衣壳蛋白上490和492位点是决定其宿主嗜性的关键但非唯一因素——这两个位点的氨基酸突变可以直接破坏HEV-4对猪肝细胞的吸附、体外感染以及对猪的体内感染能力。反之,将HEV-1相应位点突变为HEV-3/4的特征性氨基酸(490N/492M),仅能重建病毒对猪肝细胞的吸附和体外感染能力,却无法重建其对猪的体内感染能力。这一系列发现为深入理解HEV的宿主嗜性及跨物种传播机制提供了新的视角。
近日该研究成果以题为“The Crucial but Insufficient Role of E2s Domain’s Residues 490 and 492 in Determining the Host Tropism of Hepatitis E Virus”的研究论文在线发表于《自然•通讯》(Nature Communications)。我院唐自闽、杨澄宇、刘畅、应东及厦大附属妇女儿童医院温桂平为论文共同第一作者,我院郑子峥教授、夏宁邵教授、郑清炳高级工程师、李少伟教授为论文共同通讯作者。该研究获得国家自然科学基金、国家重点研发计划、福建省科技计划项目、厦门市科技计划项目及中央高校基本科研业务费等项目资助。
论文链接:https://www.nature.com/articles/s41467-026-69125-5
(公共卫生学院)